Dažnai kyla problemų nustatant, kuris iš elektrodų yra katodas, o kuris – anodas. Pirmiausia turite suprasti terminus.
Katodo ir anodo sąvoka – paprastas paaiškinimas
Sudėtingose medžiagose elektronai junginiuose tarp atomų pasiskirsto netolygiai. Dėl sąveikos dalelės iš vienos medžiagos atomo pereina į kitos medžiagos atomą. Reakcija vadinama redoksu. Elektronų praradimas vadinamas oksidacija, o elementas, kuris atiduoda elektronus, vadinamas reduktoriumi.
Elektronų pridėjimas vadinamas redukcija, priimantis elementas šiame procese yra oksidatorius. Elektronų perkėlimas iš reduktoriaus į oksidatorių gali vykti per išorinę grandinę, o tada jis gali būti naudojamas kaip elektros energijos šaltinis.Prietaisai, kuriuose cheminės reakcijos energija paverčiama elektros energija, vadinami galvaniniais elementais.
Paprasčiausias klasikinis galvaninio elemento pavyzdys – dvi plokštės, pagamintos iš skirtingų metalų ir panardintos į elektrolito tirpalą. Tokioje sistemoje viename metale vyksta oksidacija, o kitame – redukcija.
SVARBU! Elektrodas, kuriame vyksta oksidacija, vadinamas anodu. Elektrodas, ant kurio vyksta redukcija, yra katodas.
Iš mokyklinių chemijos vadovėlių žinomas vario-cinko galvaninio elemento pavyzdys, kuris veikia dėl cinko ir vario sulfato reakcijos energijos. Jacobi-Daniel prietaise vario plokštelė dedama į vario sulfato tirpalą (vario elektrodą), cinko plokštė panardinama į cinko sulfato tirpalą (cinko elektrodas). Cinko elektrodas tirpalui išskiria katijonus, sukurdamas jame teigiamo krūvio perteklių, o prie vario elektrodo tirpalas yra išeikvotas katijonais, čia tirpalas yra neigiamai įkrautas.
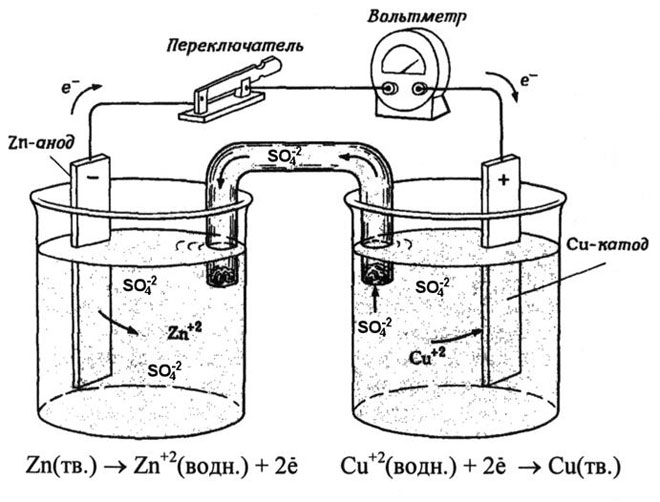
Išorinės grandinės uždarymas sukelia elektronų srautą iš cinko elektrodo į varinį elektrodą. Pusiausvyros santykiai fazių ribose nutrūksta. Vyksta oksidacijos-redukcijos reakcija.
Spontaniškos cheminės reakcijos energija paverčiama elektros energija.
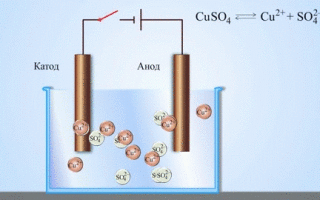
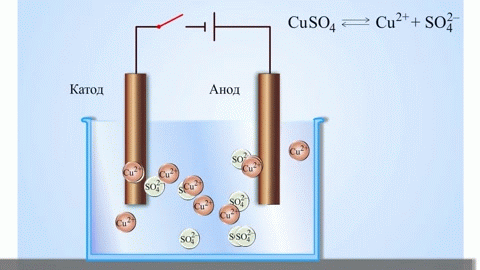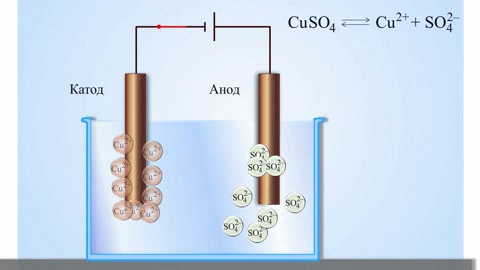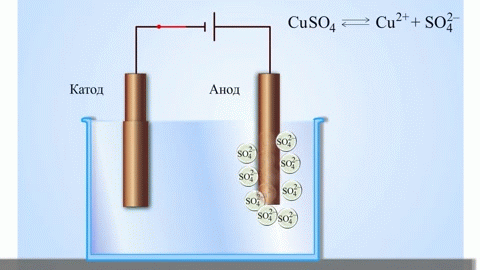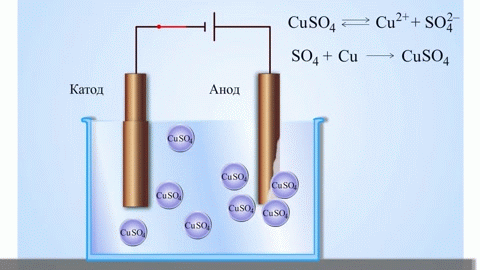
Jei cheminę reakciją sukelia išorinė elektros srovės energija, vyksta procesas, vadinamas elektrolize. Elektrolizės metu vykstantys procesai yra atvirkštiniai procesams, vykstantiems veikiant galvaniniam elementui.
DĖMESIO! Elektrodas, kuriame vyksta redukcija, dar vadinamas katodu, tačiau elektrolizės metu jis įkraunamas neigiamai, o anodas – teigiamai.
Taikymas elektrochemijoje
Anodai ir katodai dalyvauja daugelyje cheminių reakcijų:
- elektrolizė;
- Elektrinis ištraukimas;
- galvanizavimas;
- Elektrotipas.
Metalai gaunami elektrolizės būdu išlydytus junginius ir vandeninius tirpalus, metalai išvalomi nuo priemaišų ir išgaunami vertingi komponentai (elektrolitinis rafinavimas). Plokštės liejamos iš valomo metalo. Jie dedami kaip anodai elektrolizatoriuje. Veikiamas elektros srovės, metalas ištirpsta. Jo katijonai ištirpsta ir išleidžiami ant katodo, sudarydami gryno metalo nuosėdas. Priemaišos, esančios originalioje neišvalytoje metalinėje plokštelėje, lieka netirpios kaip anodo dumblas arba patenka į elektrolitą, kur jos pašalinamos. Varis, nikelis, švinas, auksas, sidabras, alavas yra apdorojami elektrolitiniu būdu.
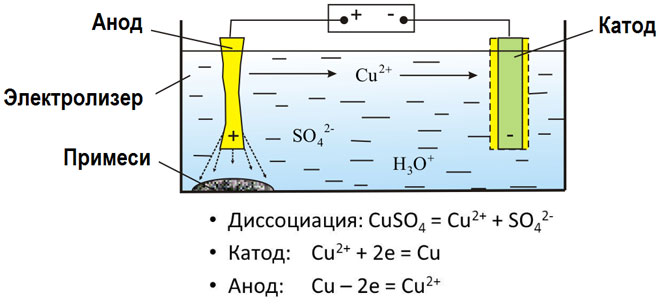
Elektroekstrakcija yra metalo atskyrimas nuo tirpalo elektrolizės metu. Kad metalas ištirptų, jis apdorojamas specialiais reagentais. Proceso metu ant katodo nusodinamas didelio grynumo metalas. Taip gaunamas cinkas, varis, kadmis.
Norint išvengti korozijos, suteikti tvirtumo, papuošti gaminį, vieno metalo paviršius padengiamas kito sluoksniu. Šis procesas vadinamas galvanizavimu.

Galvaninis padengimas yra metalo kopijų gavimo iš masinių objektų procesas, naudojant metalo nusodinimą.

Taikymas vakuuminiuose elektroniniuose įrenginiuose
Katodo ir anodo veikimo principą vakuuminiame įrenginyje galima parodyti elektronine lempa.Tai atrodo kaip hermetiškai uždarytas indas su metalinėmis dalimis viduje. Prietaisas naudojamas elektros signalams ištaisyti, generuoti ir konvertuoti. Pagal elektrodų skaičių yra:
- diodai;
- triodai;
- tetrodai;
- pentodai ir kt.
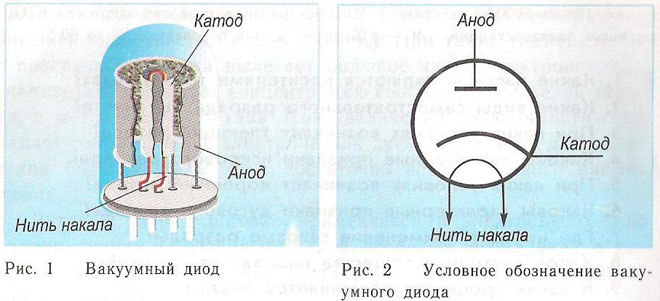
Diodas yra vakuuminis įtaisas su dviem elektrodais, katodu ir anodu. Katodas prijungtas prie neigiamo maitinimo šaltinio poliaus, anodas - prie teigiamo. Katodo paskirtis – kaitinant elektros srove iki tam tikros temperatūros, išspinduliuoti elektronus. Išspinduliuoti elektronai sukuria erdvės krūvį tarp katodo ir anodo. Greičiausi elektronai skuba prie anodo, įveikdami neigiamą erdvės krūvio potencialo barjerą. Anodas priima šias daleles. Išorinėje grandinėje sukuriama anodo srovė. Elektroninis srautas valdomas papildomais elektrodais, pritaikant jiems elektrinį potencialą. Diodų pagalba kintamoji srovė paverčiama nuolatine.
Taikymas elektronikoje
Šiandien naudojami puslaidininkiniai diodai.
Elektronikoje plačiai naudojama diodų savybė praleisti srovę į priekį ir nepraleisti priešinga kryptimi.
Šviesos diodo veikimas pagrįstas puslaidininkinių kristalų savybe švyti, kai srovė teka per p-n sandūrą į priekį.
Galvaniniai nuolatinės srovės šaltiniai – akumuliatoriai
Cheminiai elektros srovės šaltiniai, kuriuose vyksta grįžtamosios reakcijos, vadinami akumuliatoriais: jie įkraunami ir naudojami pakartotinai.

Švino akumuliatoriaus veikimo metu vyksta redokso reakcija.Metalinis švinas oksiduojasi, atiduoda savo elektronus, redukuodamas švino dioksidą, kuris priima elektronus. Akumuliatoriaus švino metalas yra anodas ir yra neigiamai įkrautas. Švino dioksidas yra katodas ir yra teigiamai įkrautas.
Akumuliatoriui išsikraunant, sunaudojamos katodo ir anodo medžiagos bei jų elektrolitas – sieros rūgštis. Norėdami įkrauti akumuliatorių, jis prijungtas prie srovės šaltinio (pliuso prie pliuso, minuso prie minuso). Dabar srovės kryptis yra priešinga, nei buvo, kai baterija buvo išsikrovusi. Elektrocheminiai procesai ant elektrodų yra „atvirkščiai“. Dabar švino elektrodas tampa katodu, jame vyksta redukcijos procesas, o švino dioksidas tampa anodu, vyksta oksidacijos procedūra. Akumuliatorius iš naujo sukuria jo veikimui reikalingas medžiagas.
Kodėl kyla painiava?
Problema kyla dėl to, kad tam tikras krūvio ženklas negali būti tvirtai pritvirtintas prie anodo ar katodo. Dažnai katodas yra teigiamai įkrautas elektrodas, o anodas yra neigiamas. Dažnai, bet ne visada. Viskas priklauso nuo proceso, vykstančio ant elektrodo.
DĖMESIO! Dalis, kuri dedama į elektrolitą, gali būti ir anodas, ir katodas. Viskas priklauso nuo proceso tikslo: ant jo reikia uždėti kitą metalo sluoksnį arba jį nuimti.
Kaip atpažinti anodą ir katodą
Elektrochemijoje anodas yra elektrodas, prie kurio vyksta oksidacijos procesai, katodas yra elektrodas, kuriame vyksta redukcija.
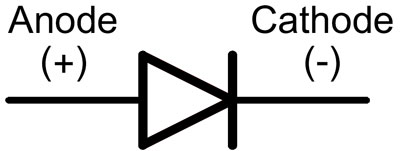
Dioduose čiaupai vadinami anodu ir katodu. Srovė tekės per diodą, jei anodo čiaupas prijungtas prie "pliuso", "katodinis" - prie "minuso".
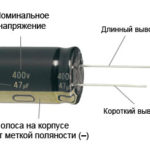
Naujam šviesos diodui su nenupjautais kontaktais anodas ir katodas nustatomi vizualiai pagal ilgį. Katodas yra trumpesnis.

Jei kontaktai nukirpti, padės prie jų pritvirtinta baterija. Kai sutaps poliškumas, pasirodys šviesa.
Anodo ir katodo ženklas
Elektrochemijoje teisingiau kalbėti ne apie elektrodų krūvių požymius, o apie juose vykstančius procesus. Redukcijos reakcija vyksta katode, o oksidacijos - anode.
Elektrotechnikoje srovei tekėti katodas jungiamas prie neigiamo srovės šaltinio poliaus, anodas prie teigiamo.
Panašūs straipsniai: